Глава 8. Электрические заряды. Основы химии
Электризация предметов. Электрические заряды. Строение атома ! Сила взаимодействия неподвижных зарядов. Закон Кулона. Периодическая система элементов Д.И. Менделеева Электроны в атоме Электроотрицательность ! Электроотрицательность и закон Кулона Химическая связь ! Ионные и молекулярные кристаллические решетки Составление формул химических соединений ! Почему наружный электронный слой обязательно должен быть заполнен? Вода. Растворы.
Электризация предметов. Электрические заряды.
Давайте возьмем стеклянную палочку и будем 2-3 минуты с силой тереть ее кончик кусочком шелка. После такой процедуры палочка приобретает необычные свойства.
Во-первых, к ней начинают прилипать разнообразные мелкие предметы.
Во-вторых, она может передать это свойство другому предмету (для чего нужно потереть палочку об этот предмет).
В-третьих, самое удивительное, разные части этого последнего предмета начинают отталкиваться друг от друга (например, бумажные ленточки на рис. 58, отталкиваясь друг от друга, встают "дыбом"). Эбонитовая палочка, натертая шерстяной тканью, обладает точно такими же свойствами.
Однако бумажные ленточки, "заряженные" стеклянной палочкой, ПРИТЯГИВАЮТСЯ к бумажным ленточкам, "заряженным" эбонитовой палочкой.
Все описанные явления объясняются тем, что разные предметы при соприкосновении могут передавать друг другу мелкие, невидимые глазом, частицы - электроны. Они отталкиваются друг от друга, но притягиваются к другим частицам - протонам, которые имеются внутри любого предмета, но не могут переходить из одного твердого предмета в другой при соприкосновении. Протон отталкивается от другого протона, но притягивается к электрону. Свойство притягивать электроны и отталкивать протоны либо, наоборот, отталкивать электроны и притягивать протоны, физики называют электрическим зарядом. В первом случае заряд отрицательный (считается, что сам электрон тоже имеет отрицательный заряд), во втором положительный (считается, что сам протон тоже имеет положительный заряд).
? А теперь попробуйте объяснить все описанные выше события. Имейте в виду, что сила притяжения или отталкивания зависит от расстояния между частицами: чем ближе друг к другу находятся частицы, тем больше сила.
Строение атома
Любой атом состоит из ядра (оно находится в центре атома) и электронов, двигающихся вокруг него. Ядро обычно состоит из частиц двух типов: протонов и нейтронов (протоны, нейтроны, электроны и некоторые другие частицы, о которых в этой книге не рассказывается, называют элементарными частицами). Нейтроны не имеют электрического заряда, масса нейтрона почти равна массе протона. Масса электрона гораздо меньше: около 1/2000 массы протона. В любом атоме одинаковое количество протонов и электронов. Простейший атом (атом водорода) состоит из одного протона и одного электрона (рис. 59). Он не взаимодействует с заряженными предметами (т.е. не имеет электрического заряда) из-за того, что, например, к положительно заряженному предмету его электрон притягивается, а его протон отталкивается от этого предмета, причем эти две силы в точности равны друг другу. В подобной ситуации физики говорят, что два заряда различны по знаку, но равны по величине. Суммарный заряд любого атома равен нулю. Заряд электрона считают равным -1, а заряд протона +1.
Бывает, что один из электронов покидает атом. Число протонов в этом атоме оказывается на единицу больше числа электронов, а заряд его ядра на величину заряда одного электрона больше заряда всех электронов. Иначе говоря, суммарный заряд такого атома равен +1. Бывает, что атом захватывает извне добавочные электроны, приобретая суммарный отрицательный заряд. Атомы или группы атомов с добавочными или недостающими электронами называют ионами. Положительно заряженные ионы называют катионами, отрицательно заряженные - анионами.
! Сила взаимодействия неподвижных зарядов. Закон Кулона
Пусть имеются два неподвижных положительных заряда величиной +q1
и +q2 (то есть в первом из них протонов на q1
больше, чем электронов, а во втором - на q2), удаленных на
расстояние R друг от друга (рис. 60). Первый из них действует на второй
силой ![]() ,
второй на первый - силой
,
второй на первый - силой ![]() . По третьему закону Ньютона
. По третьему закону Ньютона ![]() = -
= - ![]() . Будем теперь изменять q1,
q2 и R, и посмотрим, как изменяется сила
взаимодействия зарядов. Выяснится, что величина этой силы прямо пропорциональна
величине каждого из зарядов (то есть увеличивается или уменьшается во столько
же раз), а также величине 1/R2 (последнее означает, что при
изменении R сила увеличивается или уменьшается во столько же раз, во
сколько и 1/R2 , а не R; например, если R
увеличилось в два раза, то сила уменьшится в 4 раза):
. Будем теперь изменять q1,
q2 и R, и посмотрим, как изменяется сила
взаимодействия зарядов. Выяснится, что величина этой силы прямо пропорциональна
величине каждого из зарядов (то есть увеличивается или уменьшается во столько
же раз), а также величине 1/R2 (последнее означает, что при
изменении R сила увеличивается или уменьшается во столько же раз, во
сколько и 1/R2 , а не R; например, если R
увеличилось в два раза, то сила уменьшится в 4 раза):
|
| |
|
| |
|
| |
Эти три утверждения
можно соединить в одно (мы не будем доказывать правильность такой замены,
можете проверить ее на нескольких конкретных примерах):
![]()
Однако эта формула
еще не позволяет, зная заряды и расстояние, вычислить величину силы. Она
позволяет только сказать, во сколько раз изменилась сила по сравнению с
"начальной" ситуацией. Такой начальной ситуацией можно договориться
считать вариант, когда оба заряда равны +1 (то есть заряду протона), а
расстояние равно какой-то единице измерения расстояний, например, 1 метру.
Предположим, мы действительно взяли два единичных заряда, поместили их на
единичном расстоянии друг от друга, и измерили величину силы. Она оказалась
равна k. Теперь можно сказать, что в нашей ситуации величина силы больше
этого начального значения в (q1 · q2) /R2
раз:
![]()
Это и есть
математическая формулировка закона Кулона. Она скоро пригодится нам при
обсуждении силы притяжения электронов к атомам.
? Ион имеет заряд +3, в нем 10 электронов. Определите заряд ядра.
Периодическая система элементов Д.И. Менделеева
Атомы сравнительно легко приобретают или теряют электроны, превращаясь в ионы. Гораздо труднее "заставить" атом потерять или приобрести протоны или нейтроны. В обычных условиях ядра большинства атомов никак не изменяются в течение сколь угодно долгого времени. Все известные науке варианты строения атомов объединены в таблицу, названную по имени ее создателя "Периодическая система элементов Д.И. Менделеева". Одну клетку в этой таблице "занимает" элемент, то есть все атомы Вселенной, имеющие одинаковый заряд ядра. Иначе говоря, все атомы данного элемента имеют одинаковое количество протонов, равное порядковому номеру этой клетки. Например, в природе существует три вида атомов с одним единственным протоном в ядре: протий - вообще без нейтронов, дейтерий - с одним, и тритий - с двумя нейтронами (рис. 61). Любой из этих атомов является атомом водорода, и в таблице Менделеева находится в клетке N1. Атомы с одинаковым зарядом ядра, но различным числом нейтронов и, соответственно, с различной массой атома, называют изотопами ("изо" - "одинаковый", "топос" - "место"). Протий, дейтерий и тритий - изотопы водорода.
Первые три строчки (их принято называть периодами) таблицы Менделеева изображены в табл. 6 (в каждой клеточке таблицы вверху - порядковый номер элемента, расположенного в этой клеточке, в центре - его обозначение (символ) в химических формулах, внизу - его название). Столбцы таблицы Менделеева называют группами.
Табл. 6. Первые три периода периодической системы элементов Д.И. Менделеева
группы периоды |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
I |
1 H |
2 He | ||||||
II |
3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne |
III |
11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar |
Электроны в атоме
Электроны в атоме непрерывно двигаются в пространстве около ядра. Есть физический закон (принцип неопределенности Гейзенберга), по которому задача точного прослеживания местонахождения и скорости движущегося электрона (в том числе - в атоме) в принципе не может быть решена. Можно лишь указать для каждого электрона область пространства внутри атома, внутри которой он находится столько-то процентов времени.
? Возьмите карту Вашего города и нарисуйте на ней область, внутри которой Вы находитесь:
- не менее половины суток,
- не менее 90 процентов суток.
Орбиталь - это область пространства, внутри которой данный электрон находится 90 процентов времени.
В атомах элементов I - III периодов встречаются s- и p- орбитали (см. рис. 62). В зависимости от расположения в пространстве различают px-, py- и pz-орбитали; в зависимости от размера 1s-, 2s- и 3s-; 2p- и 3p-орбитали (рис. 63).
Представьте себе ядро какого-нибудь атома (например, хлора), помещенное в вакуум, мимо которого пролетают свободные электроны. Один за другим эти электроны будут притягиваться к нему и "заполнять" орбитали вокруг этого ядра. Последовательность заполнения различных орбиталей вокруг ядра любого атома одинакова и показана в табл. 7.
Табл. 7. Порядок заполнения электронами орбиталей первых трех электронных слоев
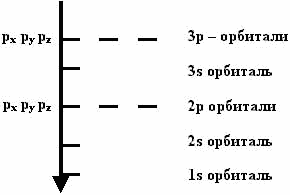
Заполнение электронами орбиталей данного атома происходит по следующим правилам:
- на одной орбитали может располагаться не более двух (0, 1 или 2) электронов;
- очередность заполнения: 1s-, 2s-, 2p-, 3s-, 3p-. В этом списке каждая следующая орбиталь (или группа орбиталей, как в случаях 2p- и 3p-) заполняется только после того, как на каждой из предыдущих окажется по два электрона;
- группы орбиталей, отличающихся только расположением в пространстве (например, 2p и 3p), заполняются так, чтобы электроны располагались как можно "свободнее". Например, система 2р- орбиталей заполняется в следующей последовательности (см. табл. 8, запись "2px1" означает, что на орбитали 2p, вытянутой вдоль выбранной нами координатной оси Ох, имеется один электрон).
Табл. 8. Порядок заполнения электронами системы 2р-орбиталей
| Общее число электронов на 2р орбиталях | Расположение электронов на 2р орбиталях |
| 0 | 2px0 2py0 2pz0 |
| 1 | 2px1 2py0 2pz0 |
| 2 | 2px1 2py1 2pz0 |
| 3 | 2px1 2py1 2pz1 |
| 4 | 2px2 2py1 2pz1 |
| 5 | 2px2 2py2 2pz1 |
| 6 | 2px2 2py2 2pz2 |
Орбитали в атомах образуют электронные слои (1-й слой: 1s-, 2-й слой: 2s- и 2p-, 3-й слой: 3s- и 3p-). Орбитали одного слоя имеют одинаковый диаметр.
Электроотрицательность
Электроотрицательность - это способность атома притягивать электроны наружного электронного слоя. Величина силы этого притяжения зависит, во-первых, от среднего расстояния от электрона до ядра (вместо этой величины можно использовать просто радиус атома) и, во-вторых, от заряда внутренней части атома (атомного остова, то есть всего атома, за исключением наружного электронного слоя - см. рис. 64). Диаметр атома постепенно уменьшается в пределах периода (увеличение заряда атомного остова "подтягивает" электроны ближе к ядру), и резко увеличивается при появлении нового электронного слоя, то есть в начале нового периода. Заряд атомного остова любого атома равен числу электронов наружного электронного слоя, взятому со знаком "+" (так как суммарный заряд атома равен нулю), и номеру группы в таблице Менделеева.
? Сравните электроотрицательность следующих атомов, не пользуясь таблицей Менделеева:
- Li (№3) и B (№5),
- Be (№4) и O (№8),
- Mg (№12) и C (№6)
РЕШЕНИЕ п.3
| Электронные формулы магния и углерода | Mg: 1s2 2s2 2px2 2py2 2pz2 3s2 | C: 1s2 2s2 2px1 2py1 2pz0 | |
| Заряд атомного остова | +2 | < | +4 |
| Радиус атома | радиус Mg (3 эл. слоя) | > | радиус C (2 эл. слоя) |
Атом магния притягивает электроны наружного слоя слабее атома углерода по двум причинам:
- наружные электроны магния располагаются в среднем дальше от ядра атома, чем наружные электроны углерода,
- заряд атомного остова у магния меньше, чем у углерода.
ОТВЕТ: электроотрицательность Mg меньше электроотрицательности C.
! Электроотрицательность и закон Кулона
В только что рассмотренной задаче, по сути
дела, был применен закон Кулона для сравнения сил притяжения электронов к двум
разным атомам. Однако взаимодействие всего атома с одним из его электронов
является взаимодействием не двух, а, например, для углерода, семи зарядов,
шесть из которых (электроны) быстро двигаются. Поэтому перед началом расчетов
строение реального атома приходится сильно упрощать (то есть использовать
вместо самого атома его модель*). В явном виде список этих упрощений выглядит
так:
- Электроотрицательность не изменится, если заменить атомный остов
точечным зарядом, расположенным в центре атома;
- Электроны наружного электронного слоя располагаются в среднем на
одинаковом расстоянии от ядра;
- Электроны наружного электронного слоя в атоме не взаимодействуют
между собой.
Иногда сравнить электроотрицательность двух атомов так, как это сделано в задаче, не удается (попробуйте сравнить электроотрицательности хлора (№17) и кислорода (№8)). Химики умеют измерять электроотрицательность атомов, проделывая для этого специальные эксперименты. Результаты этих измерений сведены в табл. 9 (в ней электроотрицательность фтора принимается равной 4,1).
Табл. 9. Электроотрицательность элементов первых трех периодов таблицы Менделеева
группы периоды |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
I |
2,1 H |
- He | ||||||
II |
0,97 Li |
1,47 Be |
2,01 B |
2,50 C |
3,07 N |
3,50 O |
4,10 F |
- Ne |
III |
1,01 Na |
1,23 Mg |
1,47 Al |
1,74 Si |
2,10 P |
2,60 S |
2,63 Cl |
- Ar |
Химическая связь
Атомы в молекулах соединены между собой химическими связями. Они бывают ионными и ковалентными.
Ионная связь - это связь между положительным и отрицательным ионами. Самый простой способ образования ионной связи: при встрече двух разных атомов самый электроотрицательный из них отрывает от другого один или несколько электронов, превращаясь в анион. Второй атом, лишившись электронов, приобретает положительный заряд (то есть превращается в катион), и немедленно притягивается к отрицательно заряженному аниону (рис. 65 а).
Ковалентная связь возникает при взаимном проникновении друг в друга орбиталей двух атомов. При этом ядра обоих атомов притягиваются к области перекрывания их орбиталей (Cильно упрощая реальную картину, можно сказать так. Представьте, что заряд электрона "размазан" по всему объему его орбитали. Тогда место, где перекрываются орбитали двух разных электронов, имеет "удвоенный" отрицательный заряд, и притягивает оба ядра - см. рис. 65б). Взаимное проникновение двух орбиталей с образованием связи возможно только в том случае, если на обоих этих орбиталях располагается в сумме не более двух электронов).
Ковалентная связь может быть полярной и неполярной.
Ковалентная связь неполярна, если связанные атомы имеют одинаковую электроотрицательность. В этом случае они с одинаковой силой притягивают зону перекрывания орбиталей, и в результате она располагается точно посередине между ними (рис. 65в)).
Ковалентная связь полярна, если связанные атомы имеют разную электроотрицательность. Тогда более электроотрицательный атом "подтягивает" зону перекрывания орбиталей ближе к себе (рис. 65б)).
Какая связь (ковалентная полярная либо ионная) возникнет между двумя разными атомами, зависит от того, насколько сильно отличаются их электроотрицательности.
! Ионные и молекулярные кристаллические решетки
Возьмем две
молекулы фторида натрия NaF. Связь между натрием и фтором - ионная, заряды их
+1 и -1. При встрече эти молекулы, разумеется, слипнутся в единую частицу (рис.
66). Причем все четыре ионные связи в этой частице имеют одинаковую прочность.
Если добавить еще несколько молекул NaF, они тоже прилипнут. Получившаяся
система называется ионной кристаллической решеткой. Если разрушить ее,
например, значительным повышением температуры, то вновь образуются отдельные
молекулы NaF. Причем в одной молекуле могут оказаться "соседи" по
кристаллической решетке, которые при формировании кристалла были в составе
разных молекул. Говорят, что в ионной кристаллической решетке
индивидуальность молекул не сохраняется.
Теперь проделаем
те же операции с молекулами хлороводорода HCl. В этой молекуле ковалентная
полярная связь. При встрече такие молекулы все равно слипнутся в единую частицу
(рис. 67), и к ней тоже прилипнут новые молекулы хлороводорода. Однако в
получившейся молекулярной кристаллической решетке есть связи двух разных
типов. Во-первых, это ковалентные полярные связи, "унаследованные" от
отдельных молекул HCl. Во-вторых, это значительно более слабые связи между
положительно и отрицательно заряженными концами молекул (без общих электронов,
только силы Кулона). Если разрушить эту решетку повышением температуры, то
образуются отдельные молекулы HCl. Причем в точности те же самые, что и при
формировании кристалла. В молекулярной кристаллической решетке
индивидуальность молекул сохраняется.
? Как
Вы думаете, какие кристаллические решетки прочнее: ионные или молекулярные?
Почему?
? Как
связаны тип кристаллической решетки и температура плавления вещества? А
температура плавления вещества и степень поляризованности ковалентных связей в
его молекуле?
Составление формул химических соединений
Чтобы ясно представить себе сам процесс образования молекул из атомов, можно иметь в виду в качестве одного из возможных вариантов, например, такую картину. Большое число указанных в условии задачи атомов помещено в вакуум. В ходе теплового движения они сталкиваются и слипаются (то есть образуют химические связи) друг с другом. Готовой молекулой считается группа связанных между собой атомов, переставшая изменяться в результате этих столкновений.
? Известно, что молекула состоит только из атомов водорода и кислорода. Сколько атомов водорода и кислорода входит в ее состав, и как они связаны между собой?
РЕШЕНИЕ
Мы разберем два способа решения подобных задач. В любом случае для начала выпишем электронные формулы обоих атомов.
H (№1): 1s1 O
(№8): 1s2 2s2 2px2 2py1
2pz1
I способ.
Метод валентных связей.
Основа этого метода - предположение, что все химические связи в будущей молекуле ковалентные. Еще одно правило: молекулы устроены так, что в них каждый атом имеет целиком заполненные орбитали наружного слоя (будем считать, что электроны, участвующие в образовании связи, принадлежат одновременно обоим связанным атомам).
Как видно из электронных формул, водород может образовать одну, а кислород - не более двух связей (для заполнения внешнего слоя кислород должен образовать обе связи). Поэтому молекула состоит из одного атома кислорода и двух атомов водорода (рис. 1а)).
Теоретически решениями этой задачи являются также более длинные молекулы, содержащие неполярные ковалентные связи, например
Н-О-О-Н, Н-О-О-О-Н и так далее. Подобные молекулы действительно могут образоваться, однако при столкновениях с соответствующими атомами их неполярные связи легко разрушаются, заменяясь полярными ковалентными связями. Наиболее устойчивы цепочки из атомов углерода (с такими молекулами Вы уже знакомы) и кремния.
Число связей, образованных данным атомом в молекуле, называется валентностью этого атома. Обычно валентность можно предсказать с помощью метода валентных связей, однако иногда атомы могут проявлять неожиданные значения валентности. Например, строение молекулы угарного газа СО методом валентных связей предсказать нельзя. В подобных случаях используют более современные методы (например, метод молекулярных орбиталей).
II способ.
Метод ионных связей.
Метод основан на предположении, что все связи в молекуле ионные, то есть при образовании молекулы более электроотрицательные атомы отбирают электроны наружного слоя у менее электроотрицательных. Причем все ионы образующейся молекулы должны иметь заполненный наружный электронный слой.
Электроотрицательность кислорода больше электроотрицательности водорода, поэтому в рамках метода ионных связей можно считать, что атомы водорода отдают электроны атомам кислорода.
Степень окисления данного атома в молекуле - это заряд данного атома, вычисленный исходя из предположения, что все химические связи этого атома - ионные.
Каждый атом водорода в данном случае отдает свой единственный электрон (приобретая на внешнем слое заполненную 1s-орбиталь и степень окисления +1). Каждый атом кислорода принимает два электрона (по одному на 2рx- и 2рy-орбитали), его степень окисления -2.
Число электронов, принятых атомами кислорода, и отданных атомами водорода, участвующими в образовании молекулы, должно быть одинаковым (физически это одни и те же электроны). В простейшем случае атом кислорода один, тогда атомов водорода - два.
ОТВЕТ: графическая формула Н-О-Н, аналитическая - Н2О.
! Почему наружный электронный слой обязательно должен быть заполнен?
Пусть мы наблюдаем
за образованием молекул из отдельных атомов, сталкивающихся друг с другом и с
частицами, получившимися при предыдущих столкновениях. Будем считать, что в
данном конкретном случае образующиеся связи - ионные. В таком случае заданный
вопрос сводится к трем более конкретным:
- Может ли появиться молекула, в которой какой-то
атом отдал атомам другого элемента не все электроны наружного слоя, и
какова ее дальнейшая судьба?
2.
Может ли какой-то атом,
отдав атомам другого элемента при нескольких первых столкновениях все электроны
наружного слоя, при очередном столкновении отдать хотя бы один электрон из
следующего слоя?
3.
Может ли какой-то атом,
полностью заполнив наружный слой, присоединить еще хотя бы один электрон?
Давайте возьмем в
качестве примера какой-нибудь атом, например, хлор, и посмотрим, как меняется
его электроотрицательность по мере отнимания у него одного электрона за другим.
Электронная формула:
Cl
(№17): 1s2 2s2 2px2 2py2
2pz2 3s2 3px2 3py2
3pz1
Заряд атомного
остова +7, наружный электронный слой - третий. Используя нашу модель для
сравнения электроотрицательности (см. стр. 24), видим, что:
1. По мере
отнимания семи наружных электронов заряд атомного остова и радиус атома не
меняются, поэтому его электроотрицательность тоже не меняется. Ответ на первый
вопрос: да, такая молекула может появиться, но при последующих
соударениях оставшиеся электроны наружного слоя этого атома будут отбираться
так же легко, как и предыдущие.
2. Когда семь
наружных электронов отобраны, наружным слоем становится второй, а заряд
атомного остова становится равным +15. В природе нет элемента, атомы
которого обладали бы электроотрицательностью, позволяющей отнять электрон у такой
частицы. Поэтому ответ на второй вопрос: безусловно нет.
3. Пусть хлор
теперь принимает электроны. Если бы он принял 4s- электрон, его наружным
слоем стал бы 4s-, а заряд атомного остова стал бы равным -2! Но
в таком случае этот 4s-электрон должен немедленно оттолкнуться от атома,
ведь одноименные заряды отталкиваются! Поэтому ответ на третий вопрос - тоже нет.
Теперь попробуем предсказать строение молекул, состоящих из атомов азота и кислорода.
N (№7): 1s2 2s2
2px1 2py1 2pz1
O
(№8): 1s2 2s2 2px2 2py1
2pz1
Электроотрицательность кислорода больше электроотрицательности азота, поэтому в рамках метода ионных связей можно считать, что атомы азота отдают электроны атомам кислорода
Азот в данном случае может отдать все пять электронов наружного слоя (при этом наружным становится заполненный первый слой, его степень окисления в этом случае +5). Кислород же принимает два электрона на 2р-орбитали, его степень окисления -2:
N+5 O-2
Попробуйте сами придумать, как определить количество атомов каждого элемента в молекуле, если известны степени их окисления.
Надо заметить, что мы предсказали далеко не все существующие в природе варианты строения молекул, состоящих из азота и кислорода. Известны, например, молекулы состава NO, N2O , NO2, N2O3. Их строение можно предсказать с помощью метода молекулярных орбиталей.
Вода. Растворы
Мы только что предсказали, пользуясь методом валентных связей, что водород и кислород образуют молекулу, состоящую из двух атомов водорода и одного атома кислорода. Это молекула воды. Обе ковалентные связи образованы 2р-электронами кислорода, поэтому угол между ними должен составлять около 90 градусов. Сами связи - ковалентные полярные, так как кислород заметно превосходит водород по электроотрицательности. Это означает, что область перекрывания орбиталей смещена в сторону атома кислорода, следовательно, он имеет небольшой отрицательный, а атомы водорода - небольшие положительные заряды. Тогда, во-первых, угол между связями в молекуле воды должен быть несколько больше 90 градусов из-за отталкивания друг от друга положительно заряженных атомов водорода (в действительности этот угол составляет примерно 109 градусов), во-вторых, молекулы воды должны стремиться повернуться друг к другу противоположно заряженными концами (рис.69).
Связь между положительно заряженным атомом водорода из одной молекулы, и каким-либо отрицательно заряженным атомом из другой молекулы (например, кислородом), называют водородной связью. Образование водородных связей снижает подвижность молекул воды, скрепляя их в группы (рис. 69). Образованию таких групп препятствует тепловое движение молекул воды. Поэтому при понижении температуры возрастают и размеры таких групп, и процент молекул воды, принявших участие в образовании групп. Объем при этом, естественно, уменьшается. При замерзании все молекулы воды образуют друг с другом водородные связи (при такой температуре они успешно противостоят тепловому движению), формируя ажурную конструкцию (кристаллическую решетку льда (рис. 70, сравн. с рис.1). Видно, что упаковка молекул при этом оказывается менее плотной, чем в жидкой воде при 0°С, поэтому объем при замерзании воды увеличивается. Отдельные участки кристаллической решетки льда начинают образовываться уже при +4°С, поэтому при охлаждении воды объем начинает увеличиваться именно с +4°С.
Давайте теперь бросим в воду маленький кристаллик поваренной соли (формула NaCl). Кристаллическая решетка этого вещества состоит из катионов натрия и анионов хлора (см. рис. 71). Молекулы воды, естественно, "облепляют" находящиеся на поверхности кристалла ионы, поворачиваясь к ним противоположно заряженными концами, и, за счет теплового движения, соединенными усилиями отрывают их от кристалла. Оторванные ионы натрия и хлора плавают по всему объему раствора в "шубе" из прочно прикрепившихся к ним молекул воды.
? Как Вы думаете, от каких особенностей поверхности твердого предмета зависит, будет она смачиваться водой или нет?